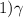Опыт 2. Исследование подвижности положения химического равновесия при изменении концентрации вещества.
В пробирке смешайте из капельниц растворы хлорида железа (III) FеСl3 и
роданида калия KSCN (по 2 – 3 капли каждого раствора). К полученному окрашенному раствору прилейте дистиллированной воды примерно на три четверти
объёма пробирки и тщательно перемешайте.
В системе устанавливается равновесие, соответствующее уравнению:
FеСl3 + 3KSCN ⇔ Fe(SCN)3 + 3KCl
Одним из продуктов указанной обратимой реакции является роданид железа (III) Fe(SCN)3 кроваво–красного цвета.
Содержимое пробирки разделите приблизительно поровну на четыре части.
11
К первой добавьте 2–3 капли раствора FеСl3 , ко второй – 2–3 капли раствора
KSCN, к третьей – немного кристаллического хлорида калия KCl и встряхните для
растворения. Сравните изменения в окраске содержимого каждой пробирки с
окраской раствора в оставшейся пробирке. Запишите свои наблюдения в таблицу.
№ пробирки
Добавляемое
вещество Наблюдения
Направление
смещения положения равновесия
Изменения концентраций веществ в системе (увеличение ↑,
уменьшение ↓)
1 FеСl3
KSCN –
Fe(SCN)3 –
KCl –
2 KSCN
FеСl3 –
Fe(SCN)3 –
KCl –
3 KCl
FеСl3 –
KSCN –
Fe(SCN)3 –
Запишите выражение константы равновесия данной реакции через равновесные концентрации веществ.
K c =
Вывод.
117
245
Ответы на вопрос:
Популярно: Химия
-
Какой объем углекислого газа выделится при добавлении к 100 гр 15%...
 allegron456707.03.2020 13:12
allegron456707.03.2020 13:12 -
Какая масса раствора с массовой долей гидроксида натрия 8 % потребуется...
 Marinr09.01.2023 22:06
Marinr09.01.2023 22:06 -
Энергия активации некоторой реакции в 3 раза больше, чем энергия активации...
 дарууунчик12.09.2021 18:38
дарууунчик12.09.2021 18:38 -
С ХИМИЕЙ 1.С какими из перечисленных веществ вступит в реакцию гидроксид...
 asfandiyrova20120.07.2022 01:40
asfandiyrova20120.07.2022 01:40 -
Вычислить массу (г) молекулы nh₃, если m(nh₃) = 17 г/моль....
 serovik2407.09.2022 14:10
serovik2407.09.2022 14:10 -
Составьте уравнения гидролиза солей.определите среду раствора а) mg(no3)2...
 АннаКольцева02.02.2023 16:50
АннаКольцева02.02.2023 16:50 -
Врастворе к2so4 содержаться ионы калия количеством 0,52 моль.рассчитайте...
 tereshkova1127.04.2021 16:10
tereshkova1127.04.2021 16:10 -
:степень окисления атома фосфора равна -3 в соединении состава p2o3...
 bun325.02.2022 05:51
bun325.02.2022 05:51 -
Напишите: а) 3-метил-3-бутеналь; б) 2,4-дихлор-5-гексен-3-он....
 karis122.09.2022 14:14
karis122.09.2022 14:14 -
Составить уравнение.вот цепочка этиловый спирт--этилен--хлорэтан отметьте...
 DenNewLen3808.03.2021 00:56
DenNewLen3808.03.2021 00:56