Впробирках находятся бесцветные растворы уксусной кислоты, уксусногшо альдегида и мыла. определить в какой пробирке какое вещество находится.(формулы и описание каждой из реакций)
Ответы на вопрос:
альдегид можно определить по реакции серебрянного зеркала
сн3-сон + ag2o=сн3-соон + 2ag (серебро выпадает в осадок или покрывает стенки сосуда)
определение уксусной кислоты (будет ощущаться запах грушевой эссенции)
сн3соон + c5h11oh = сн3(сн2)4ососн3 + h2o
раствор мыла можно определись лакмусовой бумажкой. она изменит цвет раствора на фиолетовый
w(K2CO3)=42%
w(Na2CO3)=58%
Объяснение:
1. Запишем уравнения реакций
K2CO3+2HNO3=2KNO3+CO2+H2O
Na2CO3+2HNO3=2NaNO3+CO2+H2O
2. Пусть масса карбоната калия x г, а масса карбоната натрия - y г, тогда x+y=8,22
3. Из уравнения реакции справедлива пропорция
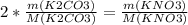 , откуда
, откуда
m(KNO3)=2*x*101/138
Аналогично для нитрата натрия
m(NaNO3)=2*y*85/106
Сумма масс нитратов нам известна
2x101/138+1y85/106=12,7
4. Составим систему и решим её
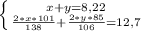
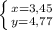
5. Массовая доля карбоната калия в смеси
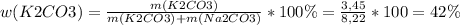
Для карбоната натрия
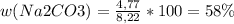
Популярно: Химия
-
Як людина може впливати на міграцію тварин? Які вам відомі «наслідки» такого...
 Hennessy77716.11.2021 02:05
Hennessy77716.11.2021 02:05 -
12. Укажіть правильні твердження: 1 Кислотним оксидам відповідають основи...
 Aysyiu30.09.2020 10:10
Aysyiu30.09.2020 10:10 -
11. Позначте порядкові номери хімічних елементів, які утворюють основи складу...
 кейсикупер101.12.2020 19:07
кейсикупер101.12.2020 19:07 -
16.Який об єм водню виділиться за н.y., якщо до 5,63 г заліза додали 38...
 ryzhij07.02.2021 22:00
ryzhij07.02.2021 22:00 -
с заданием. КАКОЙ ОБЪЁМ БУДЕТ ЗАНИМАТЬ CO2 (20°C, 99.06КПа), ПОЛУЧЕННЫЙ...
 overlordcfg07.07.2021 20:15
overlordcfg07.07.2021 20:15 -
Масова частка Карбону в речовині дорівнює 76,6 %, Гідрогену — 6,38 %, все...
 марина192504.12.2021 06:38
марина192504.12.2021 06:38 -
это сор если не сложно...
 rusrusik02.03.2021 21:49
rusrusik02.03.2021 21:49 -
Сравни относительные молекулярные массы соединений в каждой паре....
 mlkalxa7802.05.2022 23:09
mlkalxa7802.05.2022 23:09 -
Приведите примеры конкретных экзотермических, эндотермических, экзогенных...
 мугамбе21.05.2022 02:07
мугамбе21.05.2022 02:07 -
найти процентное содержание в природе:O,N,C,Si(неметаллы) и Al,Fe,Ca,+ 1...
 rodoskinatanya14.11.2021 13:18
rodoskinatanya14.11.2021 13:18
