Для растворения 5,6г оксида двухвалентного металла потребовалось 25г 29,2% соляной кислоты. Оксид какого металла был взят? ответ :CaO
Ответы на вопрос:
Дано:
m (MeO) = 5,6 г;
m (HCl) = 25 г;
ω (HCl) = 29,2 %.
Найти:
Me (металл) — ?
1. Так как это оксид двухвалентного металла, мы можем записать реакцию в общем виде.
MeO + 2HCl → MeCl₂ + H₂O.
2. Найдём массу чистого HCl.
m (HCl) = (29,2 % · 25 г) ÷ 100 = 7,3 (г) - чистого HCl.
3. Теперь найдём количество вещества (моль) HCl. По формуле: n = m ÷ M; где: n - количество вещества (моль), m - масса (г), M - молярная масса (г/моль).
n (HCl) = 7,3 г ÷ 36,5 г/моль = 0,2 (моль).
4. Через соотношение количества вещества MeO и HCl найдём число моль MeO.
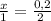 ; x = 0,1 (моль) - MeO.
; x = 0,1 (моль) - MeO.
5. Нам известна масса и количество вещества оксида металла. Теперь найдём молярную массу по формуле: M = m ÷ n; где: M - молярная масса (г/моль), m - масса (г), n - количество вещества (моль).
M (MeO) = 5,6 г ÷ 0,1 моль = 56 (г/моль).
6. Из найденной молярной массы вычтем кислород и узнаем молярную массу металла.
56 г/моль - 16 г/моль = 40 (г/моль).
Смотрим по таблице Менделеева... Это кальций (Ca).
ответ: CaO.
Объяснение:
ВОТ ОТВЕТ УКАЗАН НА ФОТОГРАФИИ, я дополнил вы написали неправильно и не до конца
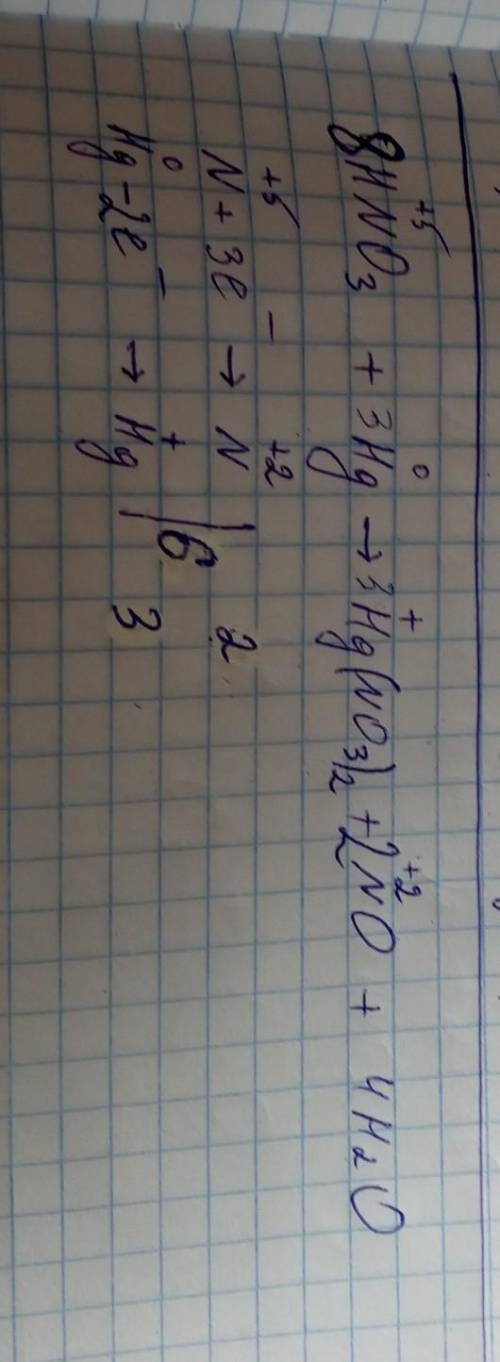
Популярно: Химия
-
Какой объем оксида углерода выделится при термическом разложении 25,2...
 Mrmors01.07.2021 04:42
Mrmors01.07.2021 04:42 -
Какие соответствия верны а) к2o- пероксид б) al2o3 - амфотерный оксид...
 Чел104673819.11.2022 12:12
Чел104673819.11.2022 12:12 -
1. какова масса продукта реакции между магнием и кислородом, если...
 Дейлионна03.10.2022 01:05
Дейлионна03.10.2022 01:05 -
Что надо добавить к fe2o3 чтобы получить fe...
 ilyas5926.12.2022 15:18
ilyas5926.12.2022 15:18 -
Определите массу 5 л аммиака(н. количество вещества аммиака заключенно...
 ручка4122.09.2020 15:37
ручка4122.09.2020 15:37 -
Сходство между анилином и аммиаком проявляется во взаимодействии при...
 baukovaevgehia216.01.2021 17:47
baukovaevgehia216.01.2021 17:47 -
Определите объём газовой смеси нормальные условия состоящие углекислого...
 rutasolntseva12.03.2021 16:33
rutasolntseva12.03.2021 16:33 -
9. При сжигании 1,86 г органического вещества, состоящего из углерода,...
 Ккамв08.03.2023 20:50
Ккамв08.03.2023 20:50 -
Определите массу насыщенного раствора сульфата магния, приготовленного...
 новичок62416.11.2020 08:09
новичок62416.11.2020 08:09 -
Хімія 8 клас рішити 2 задачі подробно...
 Рената51520.10.2022 14:14
Рената51520.10.2022 14:14
