химия 8 класс Кусочек цинка массой 13 грамм полностью растворился в растворе серной кислоты. Вычислите массу образовавшейся в данной реакции соли.
Вычислите массу газа, который выделился в результате реакции между металлическим магнием и раствором соляной кислоты массой 127,3г.
Ответы на вопрос:
32,2 г, 39 литров
Объяснение:
1) Запишем уравнение реакции:
Zn + H₂SO₄ = ZnSO₄ + H₂
n(Zn) = n(ZnSO₄) = 13 г / 65 г/моль = 0,2 моль
m(ZnSO₄) = 0,2 моль * 161 г/моль = 32,2 г
2) Запишем уравнение реакции:
Mg + 2HCl = MgCl₂ + H₂
n(HCl) = 127,3 г / 36,5 г/моль ≈ 3,4877 моль
n(H₂) = 1/2 n(HCl) = 1,74385 моль
V(H₂) = 1,74385 моль * 22,4 л/моль ≈ 39 л
Задача №1
Дано:
m(Zn)=13 г
-----
Найти:
m(соли) - ?
Решение
Реакция: 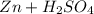 ⇒
⇒ 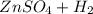 ↑
↑
ν(Zn) = 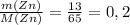 моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
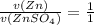 - по уравнению химической реакции (коэффициенты перед веществами в реакции - 1)
- по уравнению химической реакции (коэффициенты перед веществами в реакции - 1)
Тогда:
ν(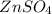 ) = ν(Zn) = 0,2 моль
) = ν(Zn) = 0,2 моль
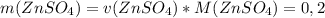 моль
моль 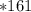 г/моль = 32,2 г
г/моль = 32,2 г
*молярная масса сульфата цинка была посчитана из таблицы Менделеева: M(Zn) + M(S) + 4*M(O) = 65 г/моль + 32 г/моль + 4*16 г/моль = 161 г/моль
ответ: 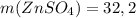 г
г
Задача №2
Дано:
m(HCl) = 127,3 г
-----
Найти:
m(газа) - ?
Решение
Реакция: 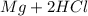 ⇒
⇒ 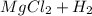 ↑
↑
ν(HCl) = 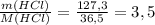 моль
моль
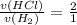 - по уравнению химической реакции (коэффициент перед HCl - 2, перед водородом - 1)
- по уравнению химической реакции (коэффициент перед HCl - 2, перед водородом - 1)
Тогда:
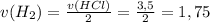 моль
моль
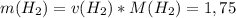 моль
моль 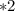 г/моль = 3,5 г
г/моль = 3,5 г
ответ: 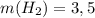 г.
г.
Популярно: Химия
-
Хто знає хімією 7 клас напишіть...
 apuha2003p07yqc26.05.2020 11:58
apuha2003p07yqc26.05.2020 11:58 -
Аммиактың күкірт қышқылымен әрекеттесу теңдеуі...
 123295501.07.2020 00:59
123295501.07.2020 00:59 -
Допоміть як найшвидше....
 вікуся4022.09.2022 23:00
вікуся4022.09.2022 23:00 -
Составить формулы оксидов магния железа(2) серы(4) натрия углерода(1)...
 ЕваЛюцифер10.11.2022 12:32
ЕваЛюцифер10.11.2022 12:32 -
Будь ласка, до ть! Визначити формулу естеру аміноетанової кислоти, в якому...
 vikysa2721.06.2021 04:52
vikysa2721.06.2021 04:52 -
Вычислите объем углерода (II) оксида (нормальные условия), Необходимый для...
 umnik8453024.10.2022 06:01
umnik8453024.10.2022 06:01 -
Ионное уравнение mgcl2+naoh=nacl+mg(oh)2...
 Ivankozyr69gmail08.01.2022 20:54
Ivankozyr69gmail08.01.2022 20:54 -
Определите степени окисления элементов в соединениях,формулы которых: а) h₂s...
 ivanivanlushch29.06.2023 06:56
ivanivanlushch29.06.2023 06:56 -
30 тому, кто решит! ! какие комплексные соединения получатся при: al2(so4)3...
 Natalivizer14.03.2020 08:22
Natalivizer14.03.2020 08:22 -
Положительная степень окисления so³...
 andreyoy01.08.2021 08:24
andreyoy01.08.2021 08:24
