Одноатомный идеальный газ совершает квазистатический процесс, определяемый уравнением P = α + β·V, где α и β некоторые постоянные величины, из состояния P1 = 300 кПа и V1 = 3 л в состояние с P2 = 100 кПа и V2 = 6 л. Чему равно отношение средней молярной теплоемкости процесса к универсальной газовой постоянной? ответ записать с точностью до десятых.
162
500
Ответы на вопрос:
-0,5
Объяснение:
Прежде всего выразим количество теплоты, подведенное к системе, воспользовавшись первым началом термодинамики:
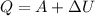
Работу по расширению газа можно найти как площадь под графиком процесса в pV координатах. Из уравнения P = α + β·V можно предположить, что график процесса - прямая линия, таким образом, работа совпадает с площадью трапеции:
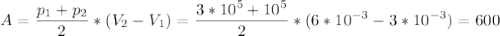 Дж
Дж
Изменение внутренней энергии определяется лишь конечным и начальным состоянием системы:
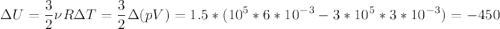 Дж
Дж
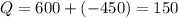 Дж
Дж
Молярная теплоемкость:
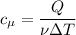
Однако:
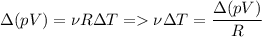
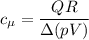
А искомое отношение:
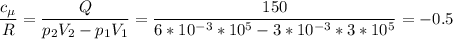
Примечание: отрицательное значение теплоемкости означает, что мы подводим тепло, а температура системы падает.
Популярно: Физика
-
Какая скорость меньше 30 км/ч или 10 м/с...
 тимур61821.09.2020 14:00
тимур61821.09.2020 14:00 -
с задачей по физики ...
 mahachik710.09.2020 08:20
mahachik710.09.2020 08:20 -
РмА 1 Задание 1 Используя уравнение Бернулли, выложите формулу еу расчет...
 helpmepls6905.11.2022 08:28
helpmepls6905.11.2022 08:28 -
по физике надо преобразовать их в си ...
 flexELITE324.12.2020 07:00
flexELITE324.12.2020 07:00 -
5. На рисунке представлен график зависимости пути от времени. Определите...
 Moldir9409.08.2022 14:36
Moldir9409.08.2022 14:36 -
Решите задачу с пропорции и определите вид зависимости между величинами...
 kaleeva160727.06.2022 18:27
kaleeva160727.06.2022 18:27 -
Провідник довжиною 20 см в магнітному полі . Сила струму рівна 1мА. Знайти...
 nazarpetrenko102.04.2021 04:21
nazarpetrenko102.04.2021 04:21 -
чи може тіло одночасно брати участь у поступальному і обертальному рухах?...
 ирина122902.04.2021 18:39
ирина122902.04.2021 18:39 -
Как найти V(t), если S(t) = 2t+1,5t^2, а X0 = 2м?...
 abubakar0026.01.2022 06:27
abubakar0026.01.2022 06:27 -
с Контрольной работой только правильно ...
 dauletkulova09.07.2022 23:37
dauletkulova09.07.2022 23:37
