Сплав магния и цинка массой 10 г, в котором
массовая доля магния 25%, обработали соляной
кислотой. Рассчитайте объем (дм³, н.у.) выделившегося
водорода.
142
295
Ответы на вопрос:
4.9 дм³ = 4.9 л
Объяснение:
Если массовая доля магния 25%, то его масса 2.5 г, а масса цинка 7.5 г
Пишем реакции
Mg + 2HCl = MgCl₂ + H₂
Zn + 2HCl = ZnCl₂ + H₂
Считаем объем водорода в первом и во втором случае
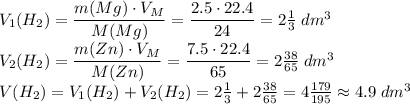
C6h12o6=2c2h5oh+2co2 m(чистой c6h12o6)=m(раствора)*w(массовая доля глюкозы)=500*30%=150 г n(c6h12o6)=m/m=150/180=0,8333 моль n(c6h12o6)=n(c2h5oh)*2=10/6=0,4167 моль m(c2h5oh)=n*m=0,4167*46=19,1682 г.
Популярно: Химия
-
1.отчего зависит свойство любого вещества. 2. Почему мы чувствуем, что...
 Valeriag200018.06.2020 21:00
Valeriag200018.06.2020 21:00 -
Доповніть речення: Етанова має хімічні властивості неорганічних і може...
 fd113228.07.2020 13:03
fd113228.07.2020 13:03 -
F2, Cl2, Br2, I2 қатарында олардың химиялық белсенділігі қалай өзгереді,...
 Серёжа33107.09.2020 09:08
Серёжа33107.09.2020 09:08 -
Складіть термо хімічне рівняння реакції горіння сірки якщо при згоренні...
 Gasashh08.09.2021 03:46
Gasashh08.09.2021 03:46 -
Структурна формула - це формула, в якій зв язки......
 123456789082508.05.2021 18:42
123456789082508.05.2021 18:42 -
Назвіть галоген, відносна густина пари ЯКОГО за повітрям дорівнює 5,52....
 яна15с31.01.2022 21:46
яна15с31.01.2022 21:46 -
Перетворіть на химични ривняння такие схемы як H2+O2...
 tanro106.04.2020 08:57
tanro106.04.2020 08:57 -
А РАСЧЕТНЫЕ ЗАДАЧИ А 1. Определите массовую долю карбоната калия и Гид-...
 Малой9814.06.2020 07:12
Малой9814.06.2020 07:12 -
Вычеслите массовую долю растворителя вещества, если в 150 грамм воды растворили...
 Акшувел18.07.2020 00:36
Акшувел18.07.2020 00:36 -
V(co)= 22,4дм3 m(al2o3)=180г m(al)-? v(co2)-?...
 dimon543414.02.2020 19:15
dimon543414.02.2020 19:15
