Слили растворы, содержащие 80г гидроксида бария и 56,8г сульфата натрия. вычислите массу полученного осадка. выход продукта реакция равен 80% от теоретического.
134
136
Ответы на вопрос:
Дано m(ba(oh)2) = 80 g m(na2so4) = 56.8 g η = 80% m практ( m(ba(oh)2 = 171 g/mol n(ba(oh)2) = m/m = 80/171 = 0.47 mol m(na2so4) = 142 g/mol n(na2so4) = m/m = 56.8 / 142 = 0.4 mol n(ba(oh)2) > n(na2so4) ba(oh)2+na2so4--> baso4+2naoh m(baso4) = 233 g/mol n(na2so4) = n(baso4) = 0.4 mol m теор (baso4) = n*m = 0.4*233 = 93.2 g m практ (baso4) 93.2*80% / 100% = 74.56 g ответ 74.56 г
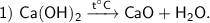
Малорастворимые в воде щёлочи (Ca(OH)₂, Sr(OH)₂) разлагаются при нагревании.
Продукты реакции : CaO — оксид кальция, H₂O — оксид водорода.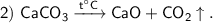
Продукты реакции : CaO — оксид кальция, СО₂ — оксид углерода (Ⅳ).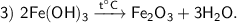
Нерастворимые в воде основания разлагаются при нагревании.
Продукты реакции : Fe₂O₃ — оксид железа (Ⅲ), H₂O — оксид водорода.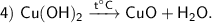
Продукты реакции : CuO — оксид меди (Ⅱ), H₂O — оксид водорода.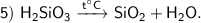
Продукты реакции : SiO₂ — оксид кремния (Ⅳ), H₂O — оксид водорода.
Популярно: Химия
-
Пркажите на рисунке атомную единицу массу...
 qwertyytrewq019226.08.2022 14:45
qwertyytrewq019226.08.2022 14:45 -
1 Х менять этот документ, лучше работать с ним в режиме защищенного просмотра....
 Сергей96503.06.2022 21:46
Сергей96503.06.2022 21:46 -
Высота стержня в 150 метров при +30 градусов по Цельсию...
 kymbatbadagulovа20.07.2020 23:36
kymbatbadagulovа20.07.2020 23:36 -
Будет рассказывать нужна ...
 ZeBrAiL2TW03.02.2020 07:23
ZeBrAiL2TW03.02.2020 07:23 -
Мел массой 20 г с массовой долей caco3 94% обработали избытком соляной...
 Польбощь01.11.2020 19:35
Польбощь01.11.2020 19:35 -
Известно, что качественной реакцией на присутствие в растворе соединений,...
 elena23201413.06.2020 07:26
elena23201413.06.2020 07:26 -
2) жәшікте 15 бұйымдар бар, оны 10 боялған жинақтаушы кездейсоқ 3-ін алады.Алынған...
 kimmatveev24.02.2021 13:45
kimmatveev24.02.2021 13:45 -
1. Формули тільки кислот наведено в ряді: а) НСІ, Н 2 SіO 3 , НІ; в) HNO...
 yulakri10.06.2020 21:45
yulakri10.06.2020 21:45 -
Б2. Веществом Х2 в цепочке превращений +Сl2 + NaOH С2Н6 → Х1 → Х2 является...
 hjdbrvjt09.06.2022 04:03
hjdbrvjt09.06.2022 04:03 -
100 БАЛЛОВ С ХИМИЕЙ!!!! Заполните пропуски в схемах химических реакций....
 lanchik0319.04.2021 21:26
lanchik0319.04.2021 21:26
