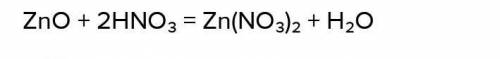.(Какую массу кристаллогидрата caci2*6h2о необходимо добавить к 47 мл 25%-го р-ра карбоната натрия плотностью 1.08г/мл, чтобы получить раствор ,в котором массовая доля na2co3 равна 10%).
Ответы на вопрос:
сначала распишем раствор карбоната натрия:
масса всего раствора - 47*1,08 = 50,76 г.
масса карбоната: 50,76*0,25 = 12,69 г.
масса воды: 50,76 - 12,69 = 38,07 г.
теперь можно перейти к уравнению реакции:
х г у г z г р г
cacl2*6h2o + na2co3 = caco3(осадок) + 2nacl + 6h2o
111+108=219 г/моль 106 г/моль 117 г/моль 108 г/моль
у = 106х/219 = 0,48х
z = 117х/219 = 0,53х,
р = 108х/219 = 0,49х.
итак 0,48х грамм карбоната натрия вступило в реакцию. осталось в растворе: 12,69 - 0,48х грамм.
воды в растворе стало: 38,07 + 0,49х грамм.
еще в растворе появился хлорид натрия: 0,53х грамм. карбоната в новом растворе должно быть 10%. составляем уравнение:
12,69 - 0,48х = 0,1(12,69 - 0,48х + 0,49х + 38,07 + 0,53х)
126,9 - 4,8х = 50,76 + 0,52х
5,32х = 76,14
х = 14,31 г.
ответ: необходимо добавить 14,31 г кристаллогидрата.
Популярно: Химия
-
Який об єм водню виділиться та маса вуглецю утворився внаслідок термічного...
 Ерерккк30.01.2020 05:26
Ерерккк30.01.2020 05:26 -
Определить массу 2.08 моль алюминия...
 shultz06111.01.2020 02:18
shultz06111.01.2020 02:18 -
Яка кількість речовини міститься у 5 г літію?...
 sukhovershaya10.10.2021 22:21
sukhovershaya10.10.2021 22:21 -
Який об єм за н. у. займе хлор(CL2) масою 17,525 г....
 pyankova0605.02.2020 00:47
pyankova0605.02.2020 00:47 -
Гомологічний ряд метану утворюють?...
 Imfind05.04.2023 17:16
Imfind05.04.2023 17:16 -
Выпишите формулы веществ, с которыми будет взаимодействовать кислота строения....
 pvpgame234514.04.2020 14:21
pvpgame234514.04.2020 14:21 -
CuCI2 - Cu(OH)2 - CuSO4 ...
 mahotinvasili11.05.2020 02:45
mahotinvasili11.05.2020 02:45 -
Составьте уравнение реакции взаимодействия этиламина с фтороводором...
 avoka07.02.2023 08:07
avoka07.02.2023 08:07 -
Напишите реакцию Ba и Sn. 1. С кальцием разбавленной и концентрированной кислотой....
 jartan11.03.2023 13:32
jartan11.03.2023 13:32 -
ОЧЕНЬ НОМЕР 190 И 193...
 Аноним2002130426.06.2023 08:40
Аноним2002130426.06.2023 08:40