К10г 5% раствора нитрата железа (ll) добавили 20г 3% раствора гидроксида калия. образовавшийся осадок растворили в соляной кислоте. вычислите массу образовавшейся соли, если выход продукта реакции 80% от теоретического
292
407
Ответы на вопрос:
1. fe(no3)2+2koh=fe(oh)2+2kno3 2. fe(oh)2+2hci=feci2+2h2o mr( fe(no3)2)=180г/моль m(ве-ва) fe(no3=10*0,05=0,5гр n( fe(no3)=m/mr=0,5/180=0,003моль m(ве-ва)koh=20*0,03=0,6гр n(koh)=m/mr=0,6/56=0,01моль находим массу fe(oh)2 по недостатку nfe(no3)2= n(fe(oh) =0,003 моль m(fe(oh)2=n*mr=0,003*90=0,27гр по второму уравнению мы видим, что n(fe(oh)2=n(feci2=0,27моль m(feci2)= m*mr=0,27*127=34,3гр 34,3гр это 100% х. 80%. m(feci2)=34,3*80/100=27,4гр ответ: m(feci2=27,4гр
1. A) 1 электрон
2.E) положительного заряда (+)
Объяснение:
S0 → S2-
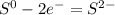
Al0 → Al3+
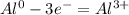
P0 → P3-
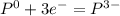
Cl0 - 3e → Cl
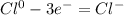
Li0 - 1e → Lix
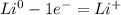
S0 - 4e → Sx
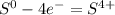
Популярно: Химия
-
Задача по химии 9 класс ,...
 захра556609.08.2021 20:10
захра556609.08.2021 20:10 -
Как можно отличить алюминий от алюминиевых сплавов?...
 guzel23129906.06.2021 11:16
guzel23129906.06.2021 11:16 -
Вопрос Реакция невозможна между оксидом кальция и Укажите правильный...
 yayuk01.06.2022 05:33
yayuk01.06.2022 05:33 -
Як перетворюють схему реакцій на рівняння? ❤...
 230390123.07.2020 15:19
230390123.07.2020 15:19 -
Рассчитайте сколько моль, литров, грамм углекислого газа выделится...
 алина382130.06.2022 22:34
алина382130.06.2022 22:34 -
Запишите уравнения реакций с которых можно осуществить следующие...
 Khedi199902.07.2022 12:54
Khedi199902.07.2022 12:54 -
3. Атомы кислорода и серы имеют на внешнем уровне …. . электронов....
 НикаМарьям20.03.2020 11:56
НикаМарьям20.03.2020 11:56 -
CaCO3, MgCl2, LiNO3, AlPO4, CaCO4, HCl, NaNO3, CaO, Na2O, LiOH,...
 agadoraaa14.05.2020 23:02
agadoraaa14.05.2020 23:02 -
Химия 10 класс Составьте уравнение CH3 ALCL3 1)CH3-3=CH-CH3+HCL-...
 жанель6727.02.2021 12:14
жанель6727.02.2021 12:14 -
Решить задачу: Какой объем углекислого газа можно получить при...
 ayvazyanloxq37n30.05.2021 15:13
ayvazyanloxq37n30.05.2021 15:13
